やや難しい記述ですが、数々の論文も読んできた当サイト読者なら理解できると思います。
※ 本文から抜粋
ファイザーおよびモデルナのコロナワクチンは、翻訳効率を上昇させるためにコロナウイルスからRNAの配列を大きく変更しています。これは翻訳が正しく行われるという前提の上に成り立っているからです。にも関わらず、シュードウリジン化mRNAワクチンは「設計図を正しく読めない」という致命的な欠点がある事が明らかになりました。ファイザーとモデルナのコロナワクチンは体内で「想定外」のタンパクを生じています。こうした異常タンパクはファイザーとモデルナのコロナワクチンの間でも異なります。作用機序不明のコロナワクチン薬害の中にはこうした異常タンパクが原因であるものが含まれる可能性も検討すべきでしょう。
シュードウリジン化mRNAワクチンはリボソームフレームシフトにより異常タンパクを生じる: Natureに掲載された論文から

mRNAは遺伝子の「設計図」です。mRNAが遺伝暗号のルールに従って3塩基ずつアミノ酸に翻訳される事でタンパク質が合成されます。しかしその際、塩基配列の挿入や欠失のために読み枠がずれると全く異なるアミノ酸配列を持つタンパクが合成されてしまいます。そのようなアミノ酸への読み枠がずれる挿入や欠失による遺伝子上の変異を「フレームシフト変異」と言います。フレームシフト変異とは、いわば設計図自体の書き間違いです。
一般論として、何かを作る際には設計図通りに作らなければ正しいものは作れません。シュードウリジン化mRNAではアミノ酸への翻訳の間違いが頻繁に起こる事が分かってきました。これはリボソームフレームシフトと呼ばれ、設計図自体は正しくとも設計図の読み間違いが起こる現象です。そしてこれはシュードウリジン化mRNAワクチンの致命的な欠陥とも言えるのです。今回はこのフレームシフトについてNature誌に掲載された論文を紹介します。
N1-methylpseudouridylation of mRNA causes +1 ribosomal frameshifting
Mulroney et al. (2023) Nature
https://www.nature.com/articles/s41586-023-06800-3#auth-Thomas_E_-Mulroney-Aff1
mRNAのN1-メチルシュードウリジル化は+1リボソームフレームシフトを引き起こす
試験管内転写 (IVT) mRNAは、重症急性呼吸器症候群コロナウイルス2 (SARS-CoV-2)のワクチンとしての使用に代表されるように、ヒトの病気と闘う事ができる様式である。IVT mRNAは標的細胞にトランスフェクトされ、そこで組換えタンパク質に翻訳され、コードされたタンパク質の生物学的活性または免疫原性により、意図された治療効果が発揮される。修飾リボヌクレオチドは、生得的な免疫原性を低下させるために、治療用IVT mRNAに一般的に組み込まれているが、mRNAの翻訳の忠実性に対するその効果については十分に検討されていない。我々は、mRNAにN1-メチルシュードウリジンを組み込むと、in vitroで+1リボソームフレームシフトが起こる事、また、ワクチン接種後、BNT162b2ワクチンmRNAの+1リボソームフレームシフト産物に対する細胞性免疫がマウスおよびヒトで生じる事を明らかにした。観察された+1リボソームフレームシフトは、おそらくIVT mRNA翻訳中にN1-メチルシュードウリジンが誘発するリボソームの失速の結果であり、フレームシフトはリボソームの滑りやすい配列で起こる。しかし、このような滑りやすい配列を同義的に標的化する事で、フレームシフト産物の産生を減少させる効果的な戦略が得られる事が示された。全体として、これらのデータは、修飾リボヌクレオチドがmRNA翻訳の忠実性にどのような影響を与えるかについての理解を深めるものであり、ヒトにおけるmRNAベースのSARS-CoV-2ワクチンの誤翻訳による有害な結果は報告されていないが、これらのデータは、将来のmRNAベースの治療薬における標的外効果の可能性を強調し、配列の最適化の必要性を示すものである。
ファイザーおよびモデルナのコロナワクチンのmRNAはN1-メチルシュードウリジン (1-メチルΨ) 化修飾を受けており、このシュードウリジン化によりmRNAが免疫系の攻撃を受けて排除されるのを避ける働きをします。
N1-メチルシュードウリジンは本来ヒトの自然なmRNAには見られない修飾です。しかし、N1-メチルシュードウリジンを含めてRNAの化学修飾がタンパク質への翻訳にどのような影響を及ぼすかはほとんど知られていません。
さて、昆虫のホタルの光は発光酵素であるルシフェラーゼによるものです。このルシフェラーゼは定量化のツールとして生命科学の現場での様々な実験に汎用されています。ちなみに成虫が発光するイメージの強いホタルですが、実際は卵や幼虫の時代にもほとんどの種類のホタルが発光します。成虫が発光する種は夜行性の種が大半を占めるのですが、夜行性の種類は主に配偶行動の交信のために発光を用いています。
MulroneyらはRNAの化学修飾が翻訳中の読み枠にどう影響するかを調べました。この時使われたレポーター遺伝子がFlucです。ルシフェラーゼを利用し、特定の箇所で翻訳の読み枠がずれると (つまりフレームシフトすると) 、ルシフェラーゼの読み枠が正しくなり、発光で検出できるというものです。

図0はリボソームフレームシフトを説明するために私自身で描いたものです。WT Fluc (野生型) は翻訳されると正常なルシフェラーゼタンパクとなり、光で検出する事ができます。FLuc +1FS (フレームシフト型) はリボソームフレームシフトを検出するためにデザインされたレポーターベクターです。
ここが少しややこしいのですが、フレームシフト型ベクターには元々フレームシフト変異が入っているために翻訳の読み枠が途中でずれています。変異の後ろ側ではアミノ酸配列が全く変わってしまうため、そのまま翻訳されても異常タンパクとなり発光しません。そしてこのフレームシフト変異を翻訳の間違いで読み飛ばすと (リボソームフレームシフト)、正常なルシフェラーゼタンパクが翻訳される事となるのです。つまり、元々の設計図のミスが、設計図の読み間違いという再度のミスによって補整されれば光で検出できるという実験デザインです。
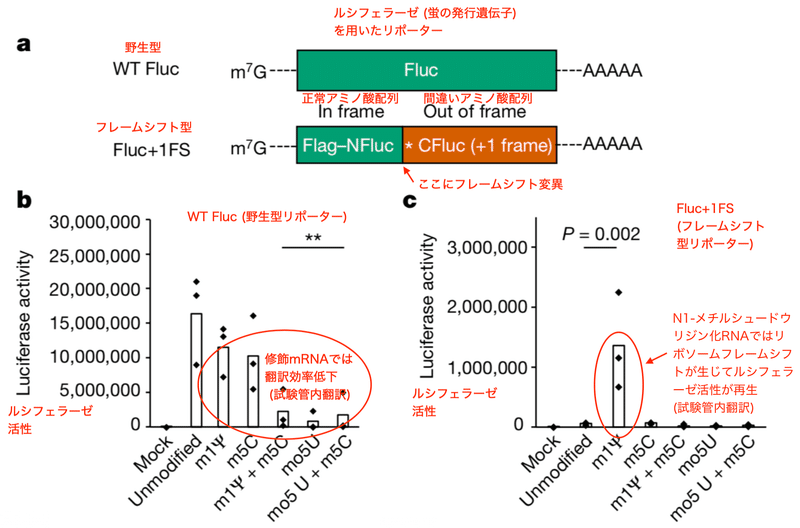
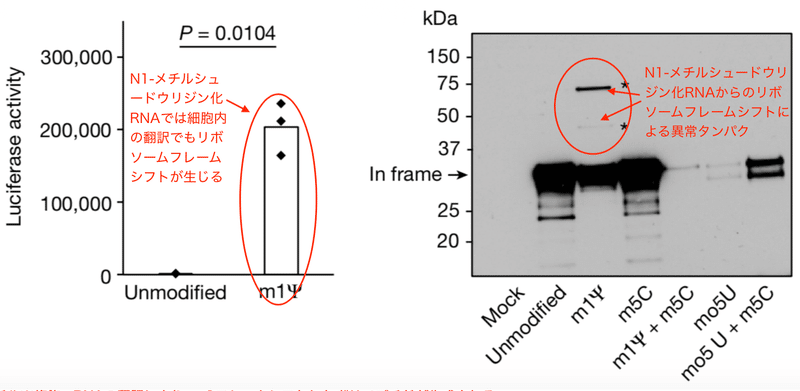
著者らはまず様々な化学修飾を受けた野生型レポーター遺伝子を試験管内 (in vitro) 翻訳し、ルシフェラーゼの活性を示す発光量で定量化しました。解析されたのは5-メトキシU、5-メチルC、1-メチルΨ、5-メトキシU+5-メチルC、1-メチルΨ+5-メチルCの化学修飾mRNAです。野生型Fluc mRNAの翻訳は1-メチルΨまたは5-メチルCの修飾だけでも若干低下しました。そして、両方のリボヌクレオチドを1つの転写産物に組み込むと、翻訳はさらに低下しました (図1b)。そしてFluc+1FSのmRNAに1-メチルΨを組み込むと、リボソーム+1のフレームシフトが有意に増加しました。その量は実に野生型Flucの約8%です (図1c)。フレームシフトは他の化学修飾mRNAでは見られませんでした (図1c)。

このように1-メチルΨは試験管内でのタンパクへの翻訳で「読み間違え」を生じました。では細胞内ではどうでしょうか。筆者らはヒト細胞株HeLa細胞を用いて検証しました。すると、1-メチルΨ化修飾フレームシフト型Fluc mRNAを導入したHeLa細胞でも試験管内翻訳と同様の結果が得られたのです。フレームシフトが再現されルシフェラーゼ活性が再生しました (図1d)。これらの観察結果から、1-メチルΨはmRNA翻訳中のリボソーム+1フレームシフトを有意に増加させると結論できます。
ウェスタンブロット法は電気泳動によって分離した特定のタンパク質を抗体で検出する手法です。翻訳産物をウェスタンブロット法で解析すると、本来の翻訳産物に加えて高分子量のバンドが2本精製されました (図1e)。これらの産物が+1フレームシフトしたポリペプチドであると推定されます。
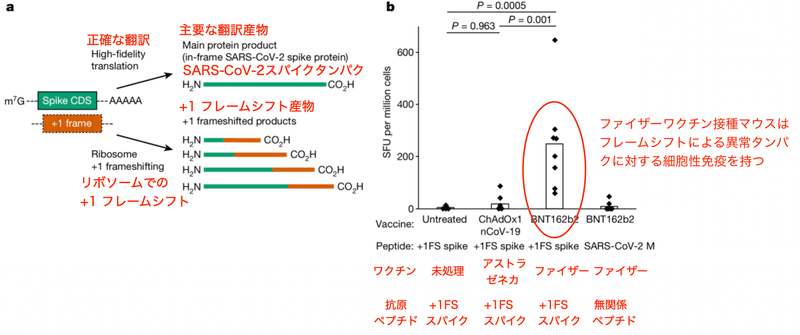
さて、これまでの解析はどれもルシフェラーゼレポーターを用いたものでした。ではコロナワクチンでも同様の現象が見られるでしょうか? また、体内でもフレームシフトが起こるのかどうかも重要です。組換え抗原mRNAの翻訳中にリボソームフレームシフトが起こると、様々な予定外のタンパク産物が作られ、予期されない免疫応答が惹起される可能性があるからです (図2a)。
酵素結合免疫吸着スポット(ELISpot) アッセイは単一細胞のサイトカイン分泌頻度を定量化する手法です。著者らはファイザーコロナワクチンをマウスに接種し、スパイクタンパク、フレームシフト産物、および無関係な対照抗原に対するT細胞応答をインターフェロン-γ (IFNγ) ELISpotアッセイによって定量しました。結果、フレームシフト産物に対する免疫応答が確かにファイザーコロナワクチン接種マウスで増加したのです (図2b)。
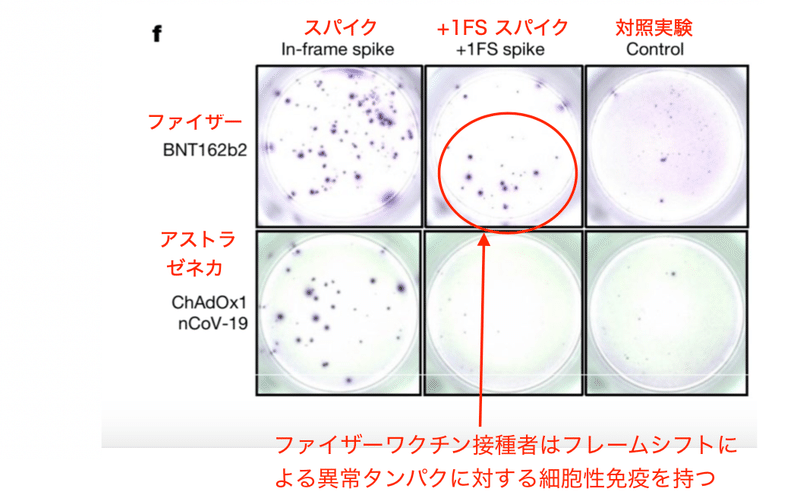
この異常な免疫応答は未処置マウスやアストラゼネカコロナワクチンを接種したマウスでは見られませんでした (図2b)。アストラゼネカのコロナワクチンにはシュードウリジンが使われていません。また、配列自体が異なるために仮にフレームシフトが起きたとしてもタンパクの配列が異なります。そのためアストラゼネカのコロナワクチンではテストされた抗原に対して免疫反応は起きないはずであり、図2bの結果は納得できるものです。

フレームシフト産物はマウスにおいて確かにT細胞抗原として働き、ワクチン接種後に異常タンパクに対する免疫が形成される事が分かります。これは人間でも同様でした。つまりファイザーコロナワクチン接種者についてもフレームシフト産物に対する免疫応答が見られたのです (図2f)。そしてこの反応はやはりアストラゼネカのワクチンでは見られませんでした (図2f)。
著者らはmRNAの配列決定も行い、フレームシフトがmRNAの変異によるものではない事も確認しています。その結果、フレームシフトはmRNAの転写エラーによるものではなく、翻訳の際のリボソームフレームシフトによるものであると結論づけられました。
通常はフレームシフトと言えば遺伝子配列上の設計図自体の間違いによって起こるものです。しかしながら、今回解析されたフレームシフトは「設計図の読み間違い」によるものです。
N1-メチルシュードウリジン は自然なmRNAに使われている素材ではなく、必ずしもリボソームにとって容易な素材ではありません。翻訳速度が低下し、リボソームが失速する際に「スリップ」するような現象が起きていると考えられます。
ELISpot応答はT細胞の全応答を代表したものではなく、T細胞応答を過小評価している可能性があります。またルシフェラーゼのレポーターベクターは特定の箇所のフレームシフトしか検出できません。このように、今回解析されたフレームシフトは全体像の一部に過ぎません。
ファイザーおよびモデルナのコロナワクチンは、翻訳効率を上昇させるためにコロナウイルスからRNAの配列を大きく変更しています。これは翻訳が正しく行われるという前提の上に成り立っているからです。にも関わらず、シュードウリジン化mRNAワクチンは「設計図を正しく読めない」という致命的な欠点がある事が明らかになりました。ファイザーとモデルナのコロナワクチンは体内で「想定外」のタンパクを生じています。こうした異常タンパクはファイザーとモデルナのコロナワクチンの間でも異なります。作用機序不明のコロナワクチン薬害の中にはこうした異常タンパクが原因であるものが含まれる可能性も検討すべきでしょう。
N1-メチルシュードウリジンはmRNAベースのヒト用ワクチンや開発中の治療薬にも含まれています。今後展開される多様な次世代mRNAワクチンの予期せぬ薬害を警戒する必要があります。
