米国FDAがファイザー社のmRNAワクチン5才未満を緊急承認しました。まだまだ世界中の人間を殺し足りないようです。米国で承認されれば、日本も自動的に承認の運びとなるでしょうから、再びコロナ禍がやってくることになります。心ある皆さんは、絶対に自分の子供に打たせてはいけません。
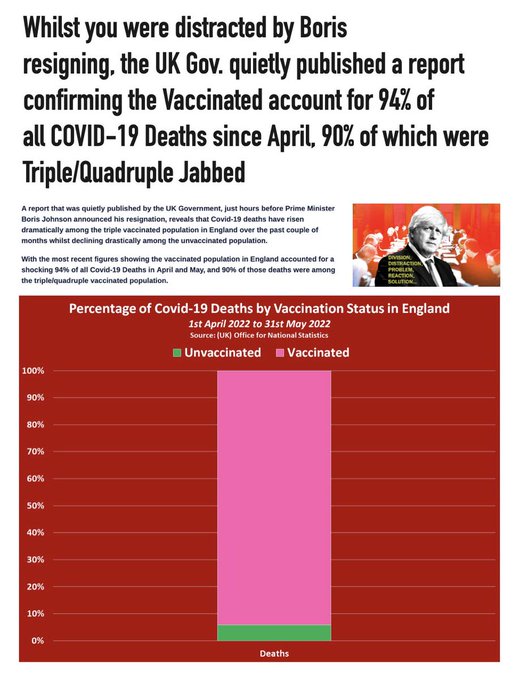
現在感染者数が拡大傾向にありますが、その内容は圧倒的多数が接種した人で、未接種者の感染はごく僅かです。イギリスにおけるコロナ感染による死亡では、ピンク=接種済み者が90%以上なのに対して未接種者=緑は10%もありません。イギリスでは打てば打つほど死亡しやすくなる局面に突入しています。2022年4月1日~5月31日データ。
5歳未満向けファイザーCOVID-19ワクチンの緊急使用認可(EUA)の概要と6つの問題点
6つの問題点
緊急使用許可のために検討された臨床試験は、本来2回接種後6ヶ月追跡した結果で判断するというものであったが、途中で修正され3回接種後の有効性を評価するものに変更された。
そのため当初の研究参加者のおよそ3分の2のデータが最終的な有効性評価には用いられないこととなった。
結果として、3回接種後7日目以降の約8週間の期間では生後6ヶ月から4歳までで80.2%の有効性が示されたが、参加者1456名中感染者はワクチン群とプラセボ群を合わせて10名と非常に少なかった。
2回接種では生後6ヶ月から4歳までのワクチン有効性は21.8%と低く、しかも統計学的に意味のある値ではなかった。
プラセボ群を含め、少なくとも12人が試験期間中に複数回の感染を経験した。そのうち10人は2回ないし3回のワクチン接種をうけており、ワクチン接種者の方が複数回感染しやすくなる可能性がある
オミクロン株(BA.1)に対する抗体価は2回接種では検出限界値程度であり、抗体価が上昇するには3回接種が必要であった。
はじめに
6月17日、FDAが5歳未満(正確には生後6ヶ月から4歳まで)の小児に対するCOVID-19ワクチンの3回接種までの緊急使用認可を承認しました。
本稿では認可申請書類をもとに、どのようなデータから認可されたのかを考えたいと思います。
本臨床試験はもともと4,526人の参加者がワクチン群とプラセボ群に2:1で割り付けられ、2回接種後の有効性を確かめるものでした。
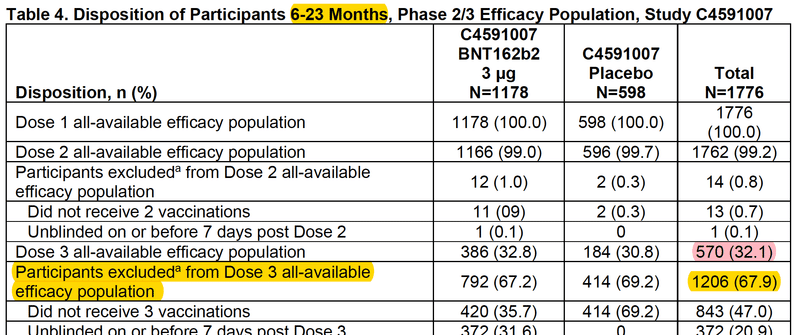
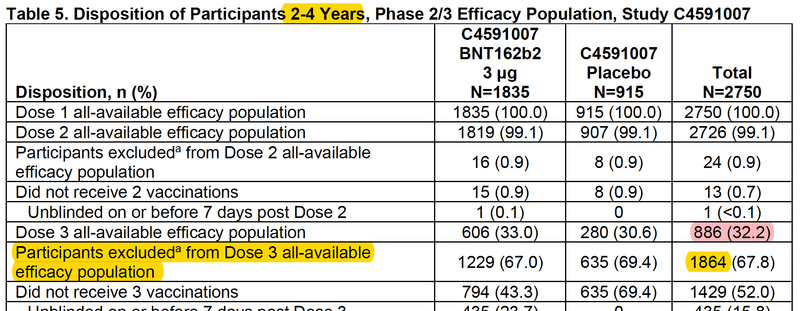
しかし2022年2月1日のプロトコル(研究計画)修正により、3回接種後の有効性を確かめるための研究となったため、およそ3分の2の参加者のデータが除外され、最終的に3回接種の有効性の確認に使われた参加者は2歳未満が570名、2-4歳が886名の計1456人となりました。
https://www.fda.gov/media/159195/download
https://www.fda.gov/media/159195/download
有効性
ワクチンの有効性がどのように評価されたかを見てみましょう。
上述の通り、ファイザーの文書によれば、本来は2回接種後に有効性を評価するはずでしたが〝実世界のデータから考えて3回接種後の有効性を評価する”ようにプロトコルが途中で修正されました。それだけでなく、修正プロトコルでは3回接種後の感染者が21名となった時点で有効性を評価することになっていましたが、本発表の時点では感染者は10名です。そのため本発表は予備的な結果であると記載されています。
また、これまでの認可では、盲検化(試験参加者が自分がワクチン群なのかプラセボ群なのか知らされない)された状態で接種後6ヶ月間は追跡して安全性、有効性を示すことが必要とされていましたが、今回は3回接種後に盲検化された状態での追跡期間は6ヶ月-23ヶ月齢では35日、2歳-4歳では40日(いずれも中央値)と極めて短いものであったことにも注意が必要です。
3回接種後の有効性
さて、発表された有効性です。
3回接種の有効性の評価の対象となったのは2歳未満が570名、2-4歳が886名の計1456名です。
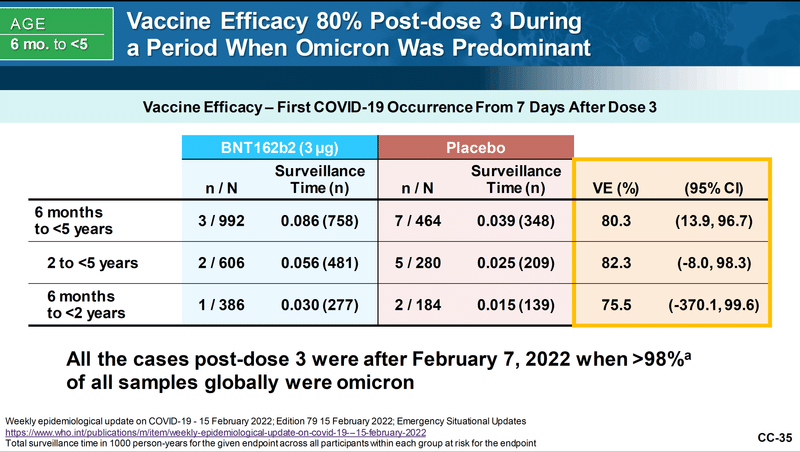
3回接種後に合計10名が感染し、6ヶ月から4歳に対する最終的なワクチンの有効性(VE)は80.3%とされました。
https://www.fda.gov/media/159258/download
80.3%という有効率は統計学的に有意なものです。しかし、3回接種まで進んだ参加者の中の陽性者は接種群、プラセボ群あわせても10名と極めて少なく、かろうじて有意となったと言わざるを得ません。
それは、上図の中段、下段を見ても明らかです。
2歳-4歳、6ヶ月-23ヶ月齢に分けて解析すると、VE(ワクチン有効率)の右の95%CI (95%信頼区間) の下限がマイナスの値になっています。これは統計学的に有意な(つまり、意味のある)有効性は得られなかったことを示しています。
では試験期間全体、つまり1回目の接種以降から3回接種後約1ヶ月半までの新型コロナの発症の違いはどうだったのでしょう。
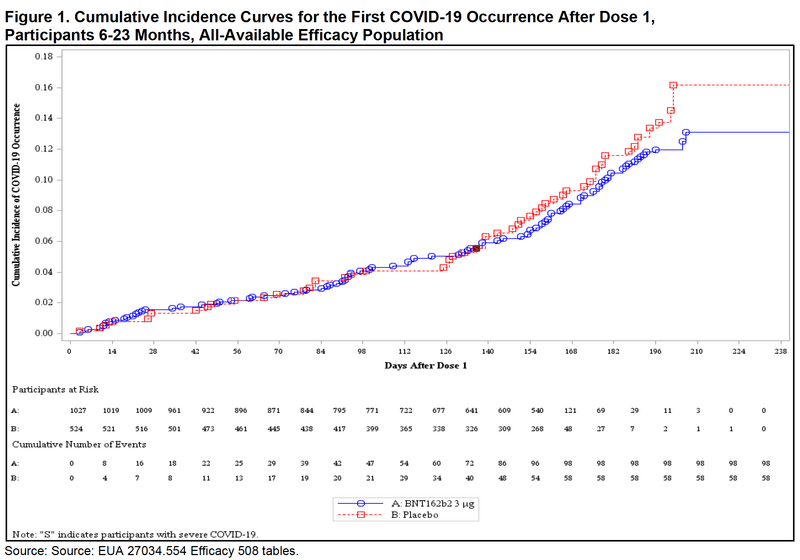
まず6ヶ月-23ヶ月齢から。
下のグラフは試験期間全体の感染者率の積み上げグラフです。赤がプラセボ群。青がワクチン群です。どうでしょうか。差が見られるでしょうか。
https://www.fda.gov/media/159195/download
https://www.fda.gov/media/159195/download
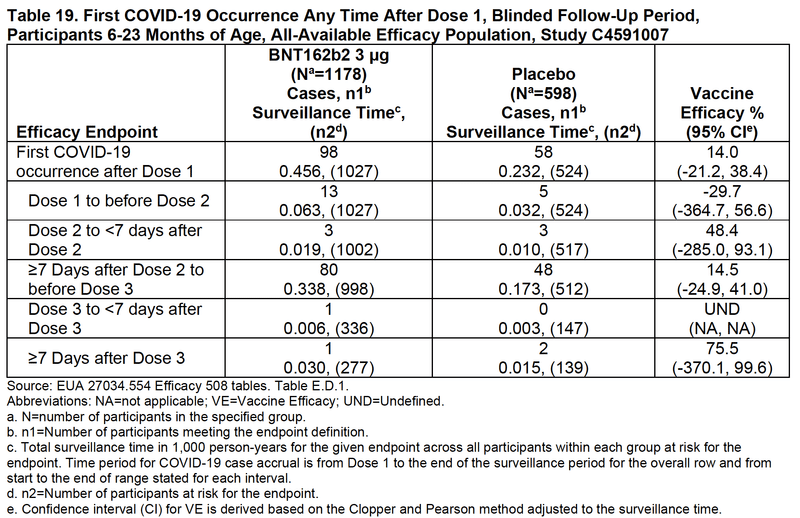
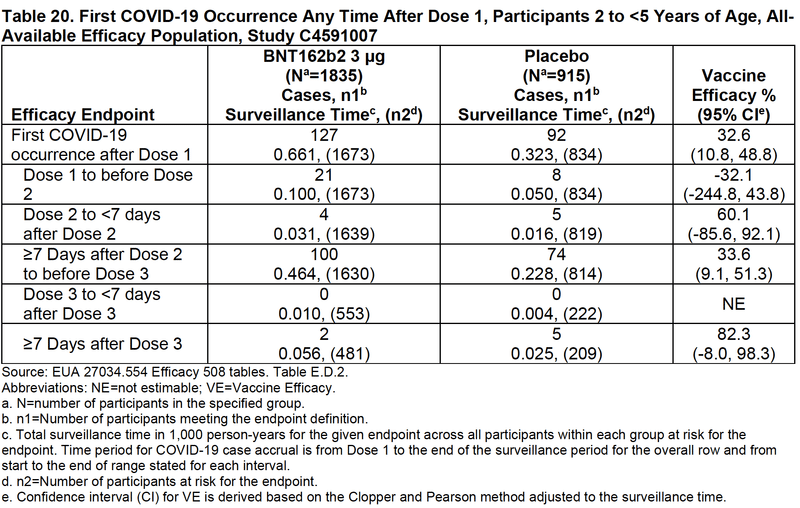
次の表は各期間のワクチン有効率を統計学的に示したものです。全ての時期においてワクチン有効率の95%信頼区間の下限はマイナスです。それだけではなく、1回接種と2回接種の間はワクチン有効率の推定値さえもがマイナスとなっています。全ての期間において確かな有効性は示されず、接種群の方が感染率が高い可能性も否定されませんでした。
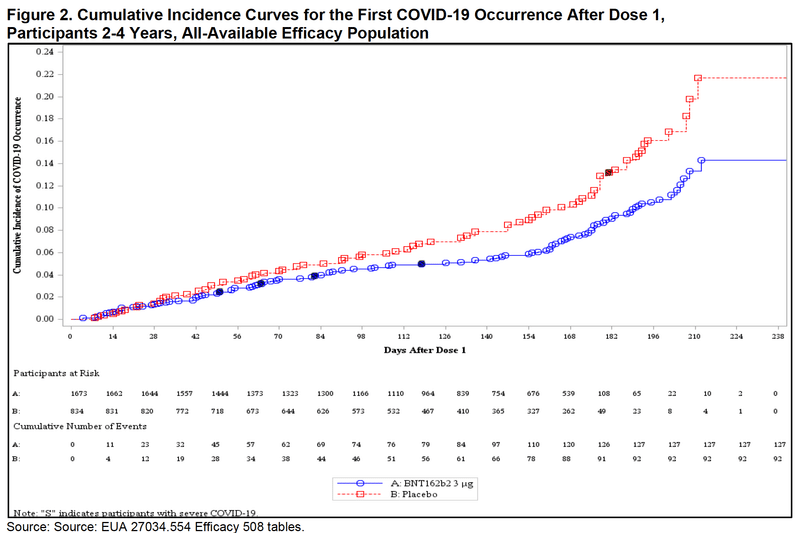
つぎに、2歳-4歳についても同様に見てみましょう。
https://www.fda.gov/media/159195/download
積み上げグラフでは6ヶ月-23ヶ月齢に比べればワクチン群(青)とプラセボ群(赤)の差があるように見えます。1回接種後112日(16週)後あたりから少しずつ差が出てきたように見えますがそれほど大きなものには見えません。
https://www.fda.gov/media/159195/download
統計学的に示した上の表では、2歳から4歳では1回接種後以降の全体のワクチン有効性は32.6%であり、2回接種後7日以降から3回接種前までの間も33.6%のワクチン有効性が統計学的に有意に示されています。しかし、2回接種の6日後までは確かな有効性が示されたとは言えず、それまでは接種群の方が感染率が高い可能性も否定できませんし、3回接種後7日以降のワクチン有効性も確実なものではありません。
本研究にはもともと4,526人の参加者がいました。しかしプロトコル変更により、最終的な3回接種後での有効性評価の対象となったのは合計1456名であることはすでに述べました。病理医のDr. Clare Craigがこの問題点について分かりやすく述べています(日本語字幕あり)
注:動画の2:00あたりでDr.Craigが”3回目の接種から7週間の期間も無視しました”と述べていますが、これは7日というところを7週間と言い間違えたと思われます。
Dr. Clare Craigによる動画は2本あります。スクロールしてご覧ください。
2回接種後7日目以降〜3回接種の前までの盲検条件下での有効性の評価
それでは、当初予定されていた2回接種後までの有効性評価はどのようなものだったのでしょうか。ファイザーがその結果を報告しています。
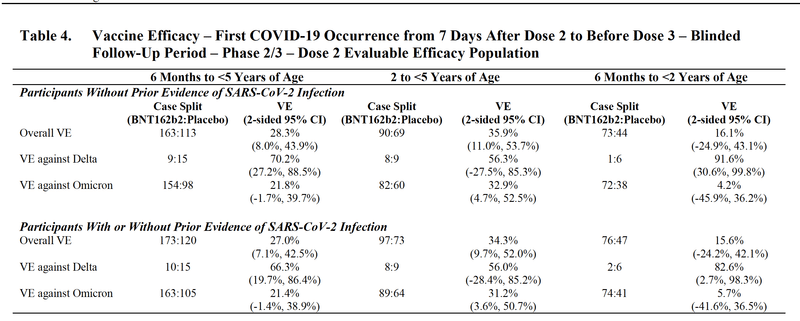
2回接種後7日目以降、3回接種の前までの盲検条件下でのワクチン有効性の評価
6ヶ月-23ヶ月齢:1762名、2-4歳:2726名(ワクチン群:プラセボ群=2:1)。
2回接種後の追跡期間(中央値)は6ヶ月-23ヶ月齢:6.3ヶ月、2-4歳:4.0ヶ月。
https://www.fda.gov/media/159193/download
上の表の上半分は初回接種前の新型コロナ感染歴がない対象者の結果で、下半分は感染歴がある者も含めた結果です。どちらもほぼ変わらないので接種前未感染の場合の結果を述べますが、2回接種後のオミクロン株に対するワクチンの有効性は2-4歳では32.9%で統計学上も有意でしたが、6ヶ月-23ヶ月齢ではわずか4.2%で統計学上有意でもありませんでした。全体(6ヶ月-4歳)で見ると21.8%ですが、統計学的に有意ではありませんでした。
FDAはこの結果に基づいて、以下のように述べています。
”3回接種後の有効性評価の対象となった全集団における投与1回以降のCOVID-19の疾患予防に関する推定ワクチン有効率は、生後6~23カ月の参加者で14.0%(95%CI:-21.2~38.3%)、2~4歳の参加者で32.6%(95%CI:10.8~48.8%)であった。
投与1回目後、投与2回目後、投与3回目前に累積した症例の事後分析では、高年齢層(2歳-4歳)で2回の投与によりCOVID-19に対する中程度の防御が示唆されたが、信頼区間が広いため解釈は限定的である。2022年4月29日時点までに発生したCOVID-19症例に基づくと、3回接種後の有効性が2回目接種後の有効性と比較して差があると結論づけることは不可能である。”
The estimated VE for the prevention of COVID-19 disease after Dose 1 in the all-available efficacy population is 14.0% (95% CI: -21.2%-38.3%) for participants 6-23 months of age and 32.6% (95% CI: 10.8%-48.8%) for participants 2-4 years of age.
The post-hoc analysis of cases accumulated after Dose 1, after Dose 2 and before Dose 3, suggests modest protection against COVID-19 following two doses in the older age group, but interpretation is limited by wide confidence intervals. It is not possible to conclude a difference between efficacy post-Dose 3 as compared to efficacy post-Dose 2 based on COVID-19 cases accrued in the study as of the April 29, 2022, cutoff date.
https://www.fda.gov/media/159195/download
試験期間中に認められた重症COVID-19
報告書では試験期間中に認められた重症例(8例)について報告しています。しかし、そのうち6例はCDCの基準では重症には当たらないものでした。つまり、本試験では殆どの感染例は重症ではなかったと考えられます。
FDAは本試験では小児用には修正した重症基準を用いています。修正の目的は「重症化の可能性に非常に高い感度を持つよう」にするため、ということでした。
以下に報告書の内容を記載します。
6ヶ月-23ヶ月齢
1例 プラセボ群(14ヶ月齢)

https://www.fda.gov/media/159193/download
この例に関してファイザーによる報告書とFDAによるレビューに記載がありますが、微妙に内容が異なります。
ファイザーによる報告書では
「データカットオフ日時点で、プラセボ群の1名が、プロトコルで規定されたFDA基準の小児用修正版による重症例基準1項目(心拍数増加[172bpm])を満たし、COVID-19が確認された。この参加者は3回接種後34日目にCOVID-19と診断されたが、重症の基準を満たさなかった。この参加者は熱性けいれんを経験し、10日後(3回接種後44日目)に心拍数が174bpmとなり、重症の基準を満たした。また、エンテロウイルスとの重複感染を認めた(表 6)。BNT162b2 群では、プロトコルに記載された重症化の基準を満たした症例はなかった。CDCの重症化基準を満たした例はなかったこの年齢層ではMIS-Cの症例は報告されなかった。」
As of the data cutoff date, 1 participant, in the placebo group, had confirmed COVID-19 which met a single severe case criterion from the protocol-specified and pediatric-modified version of the FDA criterion (increased heart rate [172 bpm]). This participant was diagnosed with COVID-19 34 days post-Dose 3 which did not meet the criteria for severe disease. Participant experienced febrile seizure and had heart rate of 174 bpm 10 days later (44 days post-Dose 3) that met the criteria for severe disease. The participant also had evidence of coinfection with enterovirus (Table 6). No cases in the BNT162b2 group fulfilled criteria described in the protocol for severe illness. No CDC criteria for severe illness were met. No cases of MIS-C were reported in this age group.
https://www.fda.gov/media/159193/download
FDAによるレビューでは以下のように記載されています。
「生後6-23ヶ月の参加者における1件のCOVID-19は、SARS-CoV-2感染の既往がない14ヶ月のプラセボ投与者で、172拍/分(bpm)の心拍数の増加(この年齢の正常カットオフは156bpm)により重症COVID-19の基準に合致した。この参加者は、発熱、鼻漏、くしゃみ、新たな咳の増加などの症状を訴えた。最初の中央検査室でのCOVID-19検査は、症状発現から5日以内に行われ、陰性であった。しかし、咳が増加したため、最初の検査から9日後に中央検査室での再検査が行われ、陽性であった。BioFire検査 [注:複数の細菌・ウイルスの網羅的検査キットの一つ] により、ヒトライノウイルス/エンテロウイルスの併発が確認された。9日後、参加者は約5-10分持続する全身の強直間代性発作の後、救急部(ED)を受診した。救急外来でのバイタルサインは 体温38.4℃、心拍数172bpmで、咳・鼻水・鼻づまりの症状が認められ、診断的検査は行われず、経過観察後、同日退院となった。すべての症状は、救急外来の受診から8日後に消失したと報告された 。発熱発作で救急外来を受診する前にベースラインに戻っていないことから,治験担当者は発熱はCOVID-19の疾病に起因する可能性があると判断した。」
One COVID-19 case in a participant 6-23 months of age met the criteria for severe COVID-19 because of an increased heart rate (HR) of 172 beats per minute (bpm), with normal cutoff for this age at 156 bpm) in a 14-month-old placebo recipient without evidence of prior SARS-CoV-2 infection. The participant reported symptoms of fever, rhinorrhea, sneezing and new or increased cough. Initial central lab COVID-19 testing was negative within 5 days of symptom onset; however, because of increased cough, repeat central lab testing was repeated 9 days after the first test and was positive. BioFire testing identified coinfection with human rhinovirus/enterovirus. Nine days later, the participant went to the emergency department (ED) after a generalized tonic-clonic seizure lasting approximately 5-10 minutes. Vital signs in the ED included a temperature of 38.4°C, HR 172 bpm, with the following symptoms noted: cough, runny nose and congestion; no diagnostic tests were performed, and the participant was discharged home the same day, after observation. All symptoms were reported as resolved 8 days after the ED visit. Because the participant had not returned back to baseline prior to the ED visit for febrile seizure, the investigator thought the fever could be attributable to COVID-19 illness.
https://www.fda.gov/media/159195/download
この患者の熱性けいれんと救急受診は果たして本当に新型コロナ感染症によるものであったのだろうか、という疑問が湧きます。
2歳-4歳
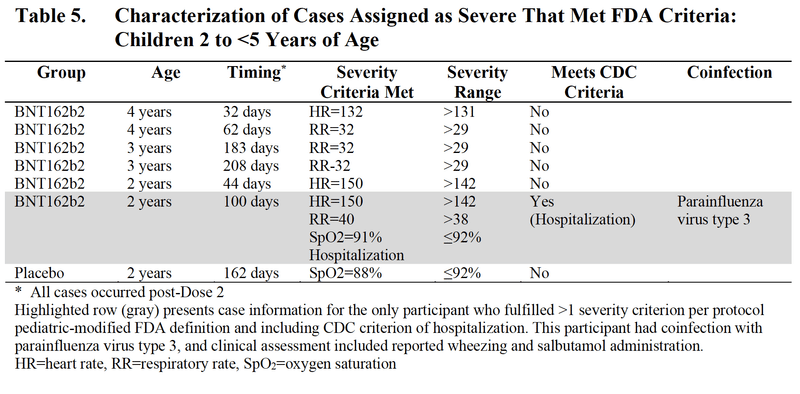
7例(6例はワクチン群、1例はプラセボ群)全て2回接種後に発生しました。
https://www.fda.gov/media/159193/download
ワクチン群
5例は心拍数や呼吸数の増加など基準の一つを満たして重症に分類されましたが、臨床的に重要ではないと治験担当者は判断しています。
CDC基準でも重症と判定されたものが1例ありました。2歳、2回接種後99日目に発症し、呼吸数の増加と血中酸素飽和度の減少により重症に分類されました。発熱、咳、息切れ有り。救急受診時、低酸素血症を呈し、肺の聴診で喘鳴が見られたため入院し、3日後に退院しました。COVID-19およびパラインフルエンザウイルス3型が陽性でした。
プラセボ群
2歳、血中酸素飽和度88%、咳、鼻詰まりで重症に分類されました。
複数回の感染
報告書には複数回感染した例についても記載があります。
6ヶ月-23ヶ月齢 ワクチン群3例、プラセボ群3例
ワクチン群は全て3回接種しています。
プラセボ群3例のうち1例はプラセボを2回接種、2例はプラセボ2回接種後、ワクチンを3回接種しています。
2歳-4歳 ワクチン群5例、プラセボ群1例
ワクチン群は1例のみ2回接種で、他の4例は3回接種、プラセボ群はプラセボを3回接種しています。
文書からは2回目感染が何回目の接種後に起こったのかは明確にはわかりませんでしたが、少なくともワクチン群もプラセボ群も複数回の感染は同様に起こるようです。厳しい見方をすれば、複数回感染した12人のうち、ワクチン接種を受けた者が10人、全く受けていない者が2人と考えることもできます。
なお、1ヶ月以内の症状の再発とPCR再陽性は複数回の感染には含まれていません。
病理医のDr. Clare Craigが指摘しているように、この複数回の感染の殆どが3回接種後であり、有効性の評価に複数回の感染も含めるのであれば、ワクチンの有効性も大きく変わっていた可能性は否定出来ません。
免疫原性(抗体価)
緊急使用許可の根拠として第一に検討されたのは、実は、上記の接種群とプラセボ群での感染率の違いではなく、ワクチンによる血液中の中和抗体産生が、これまでに認可された他年齢層(16-25歳)で示された結果と劣らないかどうかというものでした(イムノブリッジング試験)。
しかし、イムノブリッジングによって感染防御能が予測出来るという科学的な根拠はありません[WHO資料]。FDAの評価書にも「イムノブリッジングに使用される免疫マーカーは、予防効果を予測するために科学的に確立されている必要はないが、疾患と臨床的に関連性のあるものでなければならない 」

https://www.fda.gov/media/159195/download

https://www.fda.gov/media/159195/download
そして「科学的に確立された根拠はないが、これまでのデータからマーカーとして中和抗体価(中和抗体の量)を使用して問題ないだろうと判断した」と記載されています。さらに、「COVID-19に対する防御能を予測する特異的な中和抗体価は確立されていない」ため、抗体価の平均の比較と血清反応率(抗体が出来た人の割合)の二つの指標の両方で評価する、と述べています。
このように、科学的根拠の薄い評価方法でありますが、結果を見てみましょう。
2-4歳でも6ヶ月-23ヶ月齢でも3回接種1ヶ月後の血液中の抗体価は2回接種1ヶ月後の16-25歳の血液中の中和抗体価と同様であり、血清反応率も基準をクリアしました。 しかし、この中和抗体価はオリジナルの武漢株に対するものであり、試験期間、そして現在も主流であるオミクロン株に対するものではありません。
ファイザーが2回接種後のオミクロン株に対する中和抗体価を示したグラフがあります。
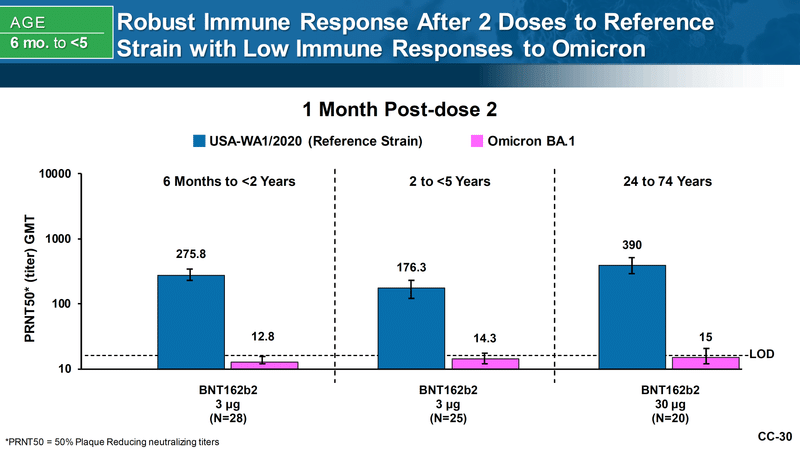
青が武漢株に対する中和抗体価、ピンクがオミクロン株に対する中和抗体価です。なんと、2回接種ではオミクロンに対する抗体価は検出限界(LOD)程度にすぎなかったことが示されています。
既に承認された大人(24-74歳)への2回接種後も同様の反応であるから、小児に対してもこのワクチンを認可すべき、という理屈のようです。
そして、オミクロン株に対する抗体価は大人同様、3回接種1ヶ月後には増加していました。
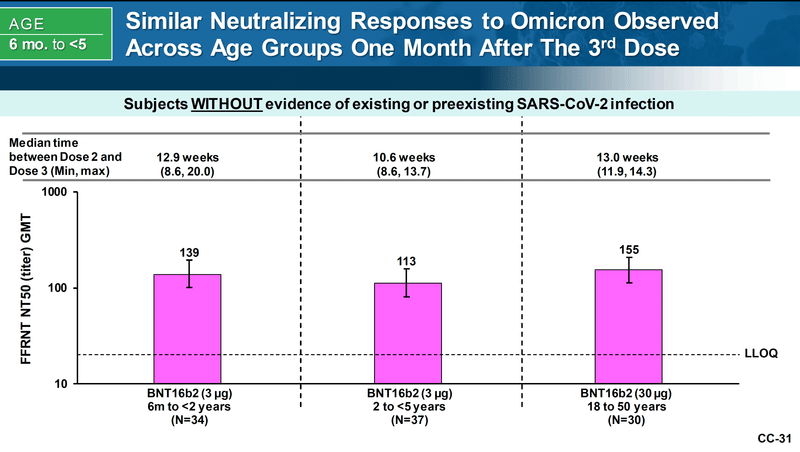
したがって、5歳未満に関しても、「3回接種すれば、他の年齢層と同様にオミクロン株による新型コロナ感染症に対する高い防御効果が得られると予想される」とファイザーは結論づけています。
At the time of the analyses, the Omicron variant of concern (VOC) emerged and real-world data in older age groups became available to suggest a third dose would lead to higher protection, particularly against this VOC. This led to the decision to immunize children 6 months to <5 years of age with three doses of BNT162b2 3-µg to ensure enhanced immune responses and protection against COVID-19 due to Omicron.
https://www.fda.gov/media/159193/download
その一方で、ファイザーは諮問委員会からの抗体価と予防効果に相関はあるのか?という質問に対し、確立された相関はない、と答えています。
諮問委員会でのやり取り
Q:みな抗体を測定しているが、予防効果との相関は?短く答えて下さい
A:予防効果に確立された相関はありません
副反応
接種直後の副反応(発熱、接種部位の痛みや腫れ)については、成人よりも頻度は低いものでした。
しかし、頻度は低くとも重大な副反応についてはこの規模の研究では見出せず、評価できないことは言うまでもないでしょう。
結論
ファイザーの報告からFDAは、このワクチンは安全であり3回接種すれば有効であると結論しました。
成人や若者での実世界のデータでも3回接種しないとオミクロンに対する発症予防も重症化予防も見込めない、したがって5歳未満においても3回接種が必要という結論です。
しかし、実世界データでもオミクロンに対する発症予防効果は急激に減弱してきています。このワクチンは5歳未満のお子さんに対し、効果を発揮するまでに少なくとも3ヶ月(初回接種から3回接種1週間後までの最短期間が12週間です)かかり、その後1ヶ月半程度の期間の有効性までしか評価されていません。しかも、有効性は2歳未満と2歳以上に分けると統計学的にも有意とはいえないものでした。
皆さんはどう考えますか?
追記:
今、オミクロンも代替わりしBA.5に取って代わろうとしています。このワクチンからさらに逃避する(さらに効果が薄い)と考えられています。