ワクチン接種で・・が起こった、という記事が多くなっています。もうこれくらいで良いのではないかと思いますが、この時期、この種の報告や論文が多く出てきています。
もう皆さんお分かりだと思います。ワクチンを接種して何も良いことはありません。ベネフィットがあるどころか、自分の身体を蝕んでいくだけです。
コロナワクチンと癌: Frontiers in Medicineに掲載された論文から 荒川 央
※AITL(angioimmunoblastic T-cell lymphoma)血管免疫芽球性T細胞リンパ腫 末尾に説明あり
コロナワクチンのブースター接種後に癌が急速に進行したという内容の論文を紹介します。患者は元々血管免疫芽球性T細胞リンパ腫 (AngioImmunoblastic T cell Lymphoma、AITL) を発症していました。AITLはT濾胞 (ろほう) ヘルパー (T follicular helper; TFH) 細胞由来の癌です。
濾胞とは、空洞を囲む小さな球状または壺状の細胞の集まりです。免疫系で代表的な濾胞は脾臓やリンパ節の胚中心です。胚中心は、体内で特異的な抗体を産生するために一時的に作られる微小組織です。コロナワクチンは筋肉注射により接種されますが、抗体は筋肉で作られるわけではなく、スパイクタンパクに対する抗体を作るためにはスパイクタンパクは胚中心に輸送される必要があります。
傷口から入った抗原は血流に入れば脾臓に運ばれてそこで胚中心が作られ、血管に入らずリンパ管に入った抗原は最寄りのリンパ節に運ばれて胚中心が作られます。胚中心で抗体遺伝子特異的に突然変異 (体細胞突然変異) が入り、抗原との親和性が高い抗体を作るB細胞が生き残る事で抗原特異的な抗体を作るようになります (親和性成熟)。この際にB細胞の選択に必要なのは、同じ抗原を認識するT濾胞ヘルパー (TFH) 細胞と、抗原抗体複合体を細胞表面にトラップした濾胞樹状細胞です。
ワクチンは抗原特異的な抗体を産生するために胚中心反応を活性化するので、胚中心由来の癌細胞の増殖も促進するのではないかと論文中で考察されています。
BNT162b2 mRNA (Pfizer/BioNTech)ワクチンブースター接種後の血管免疫芽球性T細胞リンパ腫の急速な進行
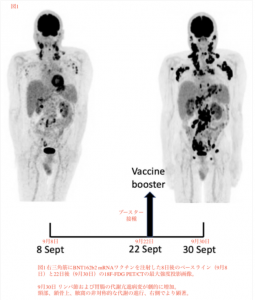
ワクチンブースター投与後22日。横隔膜上および下の既存のリンパ節腫脹の数、大きさ、代謝活性が明らかに増加した事が示された。さらに、新しい代謝亢進リンパ節と新しい代謝亢進部位が、最初の検査以来、いくつかの異なる場所で発生していた (図1、右図) 。
初回検査と比較して、全身のTLGは5.3倍と顕著に増加し、ブースター後の検査では右腋窩の増加率は左腋窩の2倍であった。
ワクチンブースター直前と21日後の抗SARS-CoV-2抗体量を比較したところ、抗スパイク抗体の産生に大きな変化は見られなかった (171 vs.147 binding antibody units/ml) 事である。
今回の症例では、ブースター接種を挟んでの22日間で癌が劇的に進行して大きくなっています。このような急速な進行は、通常のAITLの自然経過では見られません。mRNAワクチン接種がリンパ節の腫大と代謝亢進を誘発する事、TFH細胞はコロナワクチンの主要な標的の1つである事から、コロナワクチンが癌の急速な進行のトリガーとなったと考えられます。実際、癌のサイズと代謝活性の増加は、ワクチン注射部位と同じ側の腋窩リンパ節でより高かったのですが、注射部位から離れた場所にもリンパ腫と思われる新たな代謝亢進病変が現れました。悪性TFH細胞が、我々の症例に見られたRHOA G17V変異を保有している場合、mRNAワクチンに対して特に感受性が高い可能性があります。
コロナワクチンの副反応にリンパ節の膨張が知られています。リンパ節は局所的な免疫応答の場です。抗体を産生するために一時的にリンパ節が腫れる事はよくありますが、リンパ節の腫瘍が疑われる場合もあります。コロナワクチンの別の副反応として、ワクチン接種後の最初の数日間にリンパ球数の低下が見られる事があり、免疫の低下に繋がります。この2つの副反応は一見反対に見えますが、個人差もあるでしょうし、タイミングの違いもあるでしょう。また、免疫不全になるにはリンパ球全体の細胞数の低下が必要でもなく、免疫を構成する特定の細胞種がワクチン接種を繰り返す事により減少しているのかもしれません。
今回のケースではコロナワクチンが直接活性化する細胞に起源を持つ癌細胞がワクチン接種によって急激な増殖を開始したと考えられます。しかし、そうした特殊なケース以外にも、コロナワクチンには癌の進行をもたらす複数の作用機序があります。免疫低下は感染症を招きますし、癌の悪性化につながる可能性もあります。スパイクタンパクはBRCA1、53BP1などの癌抑制遺伝子の働きを抑える事が報告されており、これらのタンパクの機能低下はDNA修復の機能不全につながり、癌細胞の発生や悪性化の両方に繋がります。
癌は増殖制御の仕組みを受けつけずに勝手に増殖を行うようになった細胞集団であり、一旦増殖した癌細胞は免疫系で対処する事は難しいのです。すでに癌を患っている人はコロナワクチンによる癌の悪性化を警戒する必要があるでしょう。
※AITL(angioimmunoblastic T-cell lymphoma)血管免疫芽球性T細胞リンパ腫
リンパ節での多様な細胞浸潤と高内皮小静脈(high endothelial venule:HEV)と濾胞樹状細胞の著明な増生が特徴的な末梢性T細胞リンパ腫(peripheral T-cell lymphoma:PTCL)と定義されている。
- AITLの多くは高齢者で認められ、60~70歳台で診断される例が多い。
- 全身性リンパ節腫脹、発熱、寝汗、体重減少などの全身症状を伴う。
- 診断時に節外病変として、肝脾腫、骨髄浸潤、協水貯留、胸水貯留、皮膚病変を認める。
- 検査所見では多クローン性高γグロブリン血症、Coombs陽性自己免疫性溶血性貧血、寒冷凝集素症、クリオグロブリン血症をしばしばみる。
- 時に多発関節痛や甲状腺疾患などの自己免疫性疾患を伴う。
- しばしば免疫不全を伴い、治療前や治療中に重篤な日和見感染症を発症することがある。
- 多くの例で完全寛解を達成できるが、再発がしばしばみられる。
- 生存期間の中央値は化学療法で15~36か月、自家造血器幹細胞移植で約4年とされる。
- 化学療法後に自家造血幹細胞移植を行った症例での2年生存率67%、4年生存率59%。完全寛解導入例での生存率が高かった(J Clin Oncol. 2008;26(2):218.)
- 本邦の多施設共同研究では207例のAITL症例での発症年齢中央値67歳、3年生存率67%であり、60歳以上、白血球増多、IgA上昇、貧血、血小板減少、節外病変>1は予後増悪因子であった(Blood.2012;119:2837)。
- 直接死因は感染症が多い。