これから主流になるであろうレプリコンワクチン(自己増殖型ワクチン)。国内メーカーが開発競争に参入しているそうですが、安全なものなのか、有効性はどうなのか分からないことがあります。先発のmRNAワクチンが多くの死者を出し、後遺症患者も厖大な数になっていることから、期待は出来そうもありません。それどころか今まで以上の障害を生み出すと指摘する研究者もいる位ですから、安易に国内メーカーだからと接種しないようにして下さい。
あの副反応も減らせるかも? 体内で自己増殖する新型コロナワクチン

体内で成分が増える「自己増殖型(レプリコン)」と呼ばれる新しいタイプのワクチン開発が進んでいる。新型コロナウイルスワクチンとして、国内で複数の臨床試験(治験)も始まった。多くの人が苦しんだ副反応が減らせるかもしれないとも言う。一体どんな仕組みなのか。
「より安全で効果の高いワクチンを開発していきたい」
18日、バイオ企業のVLPセラピューティクス社は、自己増殖型の新型コロナウイルスワクチンの治験を大分大学で始めたと発表した。同社は、米国で2013年に設立されたバイオ企業で、昨年、日本支社を作った。開発は、北海道大、医薬基盤・健康・栄養研究所などと共同で行ってきたという。
自己増殖型は、新型コロナワクチンとして普及したmRNAワクチンに新たな工夫を加えた「次世代型」だ。mRNAは、たんぱく質の設計図。mRNAワクチンは、ヒトの体の中でmRNAから新型コロナウイルスのたんぱく質を作らせる。このたんぱく質を抗原として免疫反応を起こさせ、本物のウイルスが体に入った時に素早く攻撃できるようにする。
従来のmRNAワクチンは…(以下有料記事)
NTV解説 国産“次世代”ワクチン 特徴・副反応は? (ntv.co.jp)
2つの記事から考えると『レプリコン』というのは複製を意味するレプリカから来ているそうで、体内に入ると自ら増殖して増えていき、ファイザーやモデルナmRNAの10分の1から100分の1の量で十分量を生産でき、少量のため副反応も小さいと言っています。安全性については遺伝情報は10日前後でなくなるため、安全性に問題はないとして、良いこと尽くめだと言っております。
注意して欲しいのは、当サイトでこれまで登場した先生からはOKを出した人は1人もいません。もっと酷いことになると言う研究者ならいますが。
レプリコンワクチンの開発に成功したと報道がありました。極めて新しい5月19日、日本の研究所なんです。これは何かというと、セルフアンプリファイセルフself amplify = 自己増幅型のmRNAを使うということで、ウリジン修飾型の地球上にないタイプで免疫細胞に見つからないタイプで入れ込んでタンパクを作るというのは今までのタイプですが、これは免疫抑制があって感染爆発してしまう。それと有効抗体が長時間続かないという欠点。これを克服しようということです。
セルフアンプリファイ(自己増幅型)とウリジン置換型は並列で開発競争が進んできて、自己増殖型の方はいつまでタンパクを作り続けるか、コントロールが出来ないから難しいとして排除された事実があります。でも今更になってウリジン置換型は感染爆発が酷いことになっていて、さらにアジュバントで全身炎が酷いことになっているから、それならば自己増幅型でも大丈夫だといって再び始めたものです。
『変異株に対する抗体が霊長類モデルで少なくとも12ヶ月維持された』と。長いことずっとタンパクを作るから。『アルファウイルスのレプリコン発現ベクターを利用している』、これはポリメラーゼをコードしたmRNAという意味です。ポリメラーゼチェインリアクション(PCR)みたいにちょっとでも遺伝子が入れば2倍、4倍、8倍、16倍とズーッと遺伝子が増幅していくわけです。
『レプリコンベクターによるレポーター遺伝子の発現は動物モデルで最長86日』、3ヶ月間タンパクを作り続けると言っている。それによって『ワクチン接種の間隔を延長することが可能になる』。1年に1回でズーッとタンパクを作って抗体反応が起きるといっているけど、抗体が出来てもigG4無効抗体ですね、こんな長期間作られたら。
それにいちいちまともに反応していたら、免疫反応が死んじゃうから。だから免疫寛容を誘導ですね。永遠にコロナに感染しても発病もしなければ何も起きない、まるで共生ウイルスのようにコロナウイルスを取り込むというような遺伝子製剤ですね。今のものはアジュバントを入れて無理に炎症を起こしているんですけど、これはウリジン置換していないから、打てばいきなり炎症が起きますね。
危険なやつです。打てば危険、全身炎、あと一旦入ったら永遠に免疫寛容、コロナと永遠に仲良くしていく、そんな人類になって良いのでしょうか、皆さん。ダメですね。こんなもの良いというのは完全な嘘ですから。
細胞膜表面にRBDを発現するレプリコン(次世代mRNA)ワクチンで新型コロナウイルス感染症(COVID-19)変異株に広範・持続的な免疫の誘導に成功
他のパンデミック病原性ウイルスに対する基盤技術としての応用にも期待
◇新型コロナウイルスSタンパク受容体結合ドメイン(RBD)を細胞膜上に発現させるレプリコンワクチンをデザインし、開発を行った。
◇RBDを細胞膜表面に発現させると、分泌型のRBDを発現させた場合と比較してより高い免疫がマウスで誘導された。また、ガンマ株のRBDを用いると、武漢株のRBDと比較してより広範かつ持続的な中和抗体価が誘導された。
◇ハムスターおよび霊長類モデルを用いた攻撃接種実験において、ワクチン防御効果が確認された。また、変異株に対する抗体が、霊長類モデルで少なくとも12ヶ月間維持された。

国立研究開発法人医薬基盤・健康・栄養研究所、VLP Therapeutics Japan株式会社、独立行政法人国立病院機構名古屋医療センター、国立大学法人北海道大学大学院医学研究院、公立大学法人大阪 大阪公立大学の研究グループは、細胞膜表面に新型コロナウイルス受容体結合ドメイン(RBD)を発現するレプリコン(次世代mRNA)ワクチンを開発しました。
本研究で、このレプリコンワクチンの免疫は、霊長類モデルにおいて効率的にT細胞およびB細胞応答を誘導することが分かりました。武漢株またはガンマ株 RBDで免疫したハムスターと霊長類では、新型コロナウイルス武漢株に対する防御効果を示しました。また、変異株に対するRBD特異的な抗体が、霊長類モデルで少なくとも12ヶ月間維持されることが分かりました。これらの結果から、このレプリコンプラットフォームは、今後のコロナウイルス変異株に対して持続的な免疫を誘導する有用なワクチン候補となり得ると考えられます。本成果は、今後の変異株に対するワクチン開発戦略としてだけでなく、他のパンデミック病原性ウイルスに対する基盤技術としての応用可能性が期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)ワクチン開発推進事業「自己増殖RNAテクノロジーを用いたわが国における新型コロナウイルス感染症(COVID-19)に対するワクチン開発」の一環として行われました。本研究成果は5月19日、英科学誌Nature Communications(電子版)で公開されました。
研究背景・概要
新型コロナウイルス感染症は、新たな変異体の出現により拡大を続けており、全世界に配布可能かつ様々な変異株に対しても有効なワクチンの開発が急務となっています。現在、COVID-19に対するワクチンは複数承認されており、パンデミックの影響を軽減することに貢献しています。しかし、これらのワクチンによって誘導される免疫応答の持続時間は比較的短く、また、新たな変異株が出現し続けているため、ワクチン設計のさらなる改良が求められています。
本研究では、レプリコンプラットフォーム技術を利用して、COVID-19ワクチンを新規開発しました。この技術は、アルファウイルス(ウイルスの一種)のレプリコン発現ベクターを利用しています。このベクターは、レプリコンの複製・転写に必要な4種類のタンパク質(nsPs1-4)を発現し、目的の遺伝子を効率的に発現させます。この自己増幅プロセスにより、標的抗原の発現レベルおよび発現期間は、既存のmRNAワクチンプラットフォームで観察されるよりも高く、長くなります。したがって、このレプリコンプラットフォームを用いることにより免疫系へのRBD抗原の長期的な提示が期待されています。レプリコンベクターを用いて全長のSタンパク質を発現するCOVID-19ワクチン候補を開発した前臨床試験がいくつか実施されており、これらの候補ワクチンは、COVID-19攻撃接種試験において感染防御と同様に高い液性および細胞性免疫を誘導することが報告されています。
また、感染者の中和抗体の90%以上が新型コロナウイルススパイクRBDを標的とすることが報告されています。中和抗体が標的とするエピトープが最も多く存在する場所に免疫反応を集中させるため、本研究ではRBDの配列のみをレプリコンベクターに挿入する遺伝子として設計しました。
さらに、抗原を細胞表面に高頻度で発現させ、B細胞受容体に効率よく抗原を提示することで、より強い反応が誘導されることが報告されています。より強力なB細胞応答を誘導するために、本研究グループはRBDのN末端にSタンパク質のシグナル配列を、C末端にインフルエンザウイルスのヘマグルチニンタンパク質(HA)の膜アンカーを融合させました。このアプローチにより、RBDが細胞の表面に固定化され、高頻度で発現されるようになりました。本論文は、このRBDベースのレプリコン候補ワクチンの開発、および脂質ナノ粒子デリバリーシステムを用いたマウス、ハムスター、および霊長類モデルでの前臨床評価について報告するものです。
研究内容・考察
本研究で開発された新規COVID-19ワクチンの基本設計は、最適化されたRBD配列とN末端のシグナル配列、C末端の膜アンカーを融合した抗原をレプリコンベクターで発現させるものです。この設計により、中和エピトープの大部分を含むRBDに免疫反応を集中させ、非中和抗体の誘導を抑えることで、単球やマクロファージなどによる抗体を介した新型コロナウイルスの取り込みを抑制し、全身性炎症を引き起こすリスクを最小化することができます。シグナル配列と膜アンカーの追加により、RBDは細胞膜表面に効率よく発現され、マウス、ハムスター、霊長類モデルで高い免疫原性を示し、ハムスターと霊長類モデルの攻撃接種実験で防御効果があることを示しました。現在広く使用されているmRNAワクチンの懸念は、誘導される免疫応答の期間が比較的短いことであり、さらに新たな変異株の出現によって状況は更に複雑になっています。mRNAベクターによる抗原発現が2週間以内に減少するのに対し、レプリコンベクターによるレポーター遺伝子の発現は動物モデルで最長86日目まで確認できることが本研究グループや他の研究グループの報告で明らかになりました。このような発現の延長は、免疫応答の持続時間の延長に寄与すると考えられますので、この特性を活用出来れば、ワクチン接種の間隔を延長することが可能になると考えられます。
霊長類モデルを用いた実験では、レプリコンRBD(ガンマ株)-TMが高い中和抗体価を誘導するだけでなく、抗原特異的B細胞および抗原特異的T細胞の応答も誘導することが示唆されました。観察期間中、霊長類モデルにおいて抗原特異的B細胞と血漿中和活性は維持され、レプリコンRBD(ガンマ株)-TMによって誘導された抗体は、ワクチン接種後3ヶ月から6ヶ月の間にほとんど減少しませんでした。レプリコンワクチンは、ワクチン接種後の胚中心反応を促進・延長することにより、ヒトにおいて高い中和抗体とTh1バイアス免疫応答を誘導する可能性があると推測されます。
また、このレプリコンRBDワクチンのデザインは、新型コロナウイルスの他の株とのRBD配列の交換を容易に行えることを示しました。ガンマ株 RBDを発現するレプリコンワクチンは、武漢株 RBDを発現するレプリコンと比較して、オミクロン株の亜系統などの変異株に対して大きな交差反応性を示しました。ガンマ株 RBDに存在するaa484の変異は免疫逃避のために獲得されたことが知られており、最近の変異株の多くはこの位置に変異を有しており、この違いがRBD(ガンマ株)-TMのより強い交差反応性に寄与している可能性が考えられます。
研究展望
このレプリコンワクチンのさらなる開発には臨床試験での評価が必要であり、プライムワクチンとしての評価とブースターワクチンとしての評価の両方が現在進行中です。他の研究グループからも、いくつかレプリコン技術を用いたCOVID-19ワクチン臨床試験が報告されています。このレプリコンのアプローチは、今後の新型コロナウイルス変異株に対するワクチン開発戦略としてだけでなく、他のパンデミック病原性ウイルスに対するプラットフォームとしても有用となることが期待されます。
用語説明
1.レプリコン(次世代mRNA)ワクチン:少量の接種で十分な抗体が作られる、自己増殖型のmRNA(saRNA)ワクチン。現行のmRNAワクチンと比べて10~100分の1程度の接種量となることから、短期間で日本全人口分の製造が可能となることと、副反応が低減されることが期待される。新型コロナウイルス表面にある突起状のSタンパク質全体を抗原とする現行のワクチンと異なり、レプリコンワクチンはSタンパク質のうちウイルスが人の細胞に結合して感染するRBD(受容体結合部位)と呼ばれる部分のみを抗原にしている。そのため、不要な抗体を作らないことによる高い安全性と、多様なRBDへの抗体を作ることによる変異株への効果も期待される。
2.攻撃接種試験:動物にワクチンを接種したのちにウイルスに暴露することでワクチンの予防効果を調べる試験のこと
3.脂質ナノ粒子デリバリーシステム:mRNAワクチン製剤を分解させることなく効率よく標的細胞に導入するための製剤化技術のこと
論文情報
◇論文名:saRNA Vaccine Expressing Membrane-Anchored RBD Elicits Broad and Durable Immunity Against SARS-CoV-2 Variants of Concern.
◇雑誌名:Nature Communications(ウェブサイト:https://www.nature.com/ncomms/)
◇著者:Mai Komori+, Takuto Nogimori+, Amber Morey, Takashi Sekida, Keiko Ishimoto, Matthew Hassett, Yuji Masuta, Hirotaka Ode, Tomokazu Tamura, Rigel Suzuki, Jeff Alexander, Yasutoshi Kido, Kenta Matsuda, Takasuke Fukuhara, Yasumasa Iwatani, Takuya Yamamoto*, Jonathan F Smith*, Wataru Akahata*(+ 筆頭著者|* 責任著者)
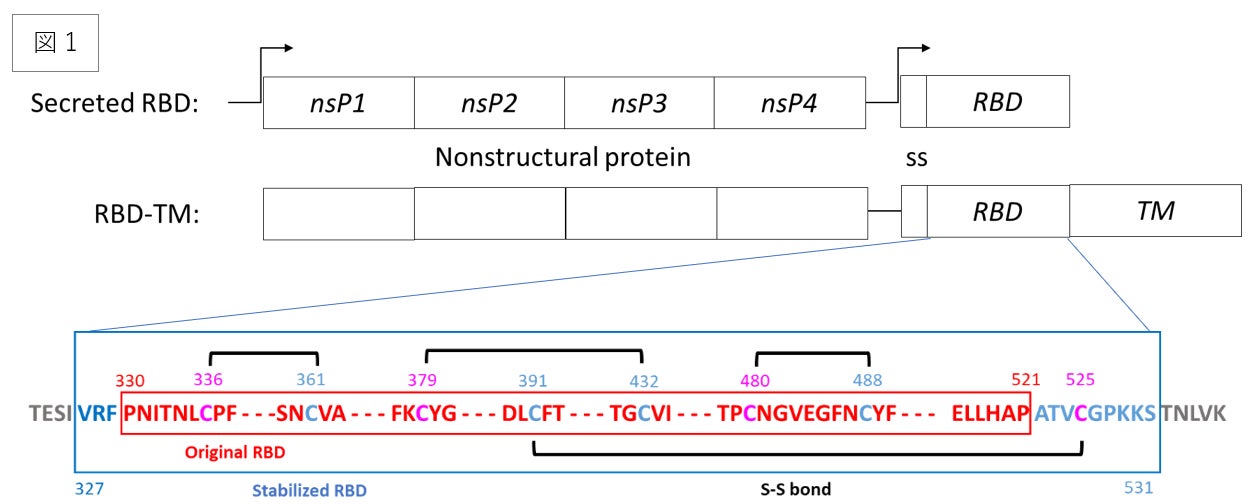
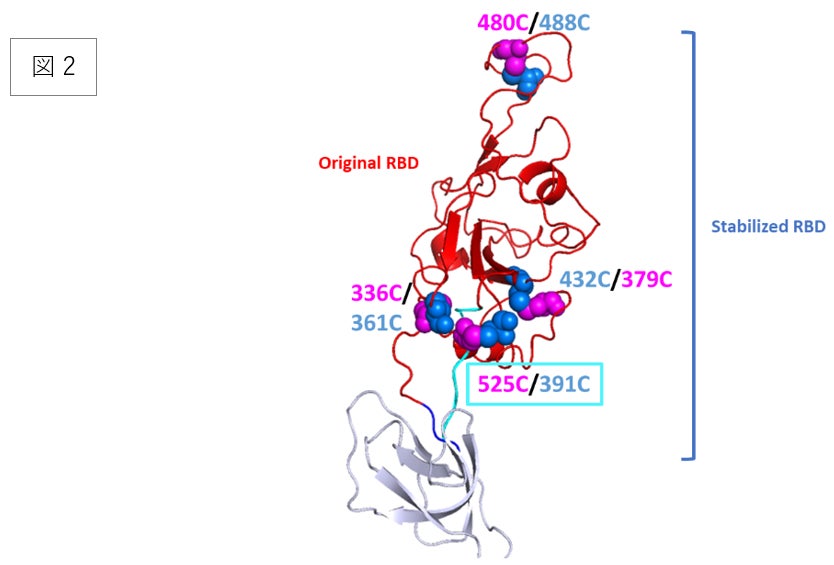
図1.RBD抗原の発現に用いるレプリコンベクターの模式図。上が分泌型RBDを発現するレプリコン、下が細胞膜上に固定されたRBDを発現するレプリコン
図2.RBD抗原のアミノ酸配列と構造モデルの模式図。赤線で囲われた配列がオリジナルのRBD、青線で囲われた配列が安定化されたRBD、そして黒線がジスフィルド結合を示す
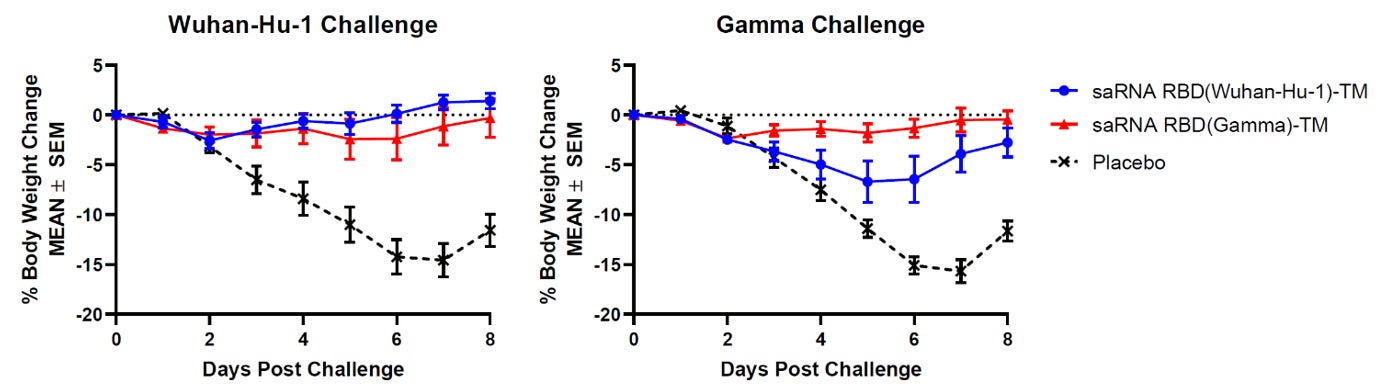
図3.レプリコンRBD(ガンマ株)-TMを2回接種したハムスターでは、新型コロナウイルス武漢株およびガンマ株での攻撃接種後に大きな体重変化は確認されなかった
◆医薬基盤・健康・栄養研究所について [https://www.nibiohn.go.jp/]
医薬基盤・健康・栄養研究所(本部:大阪府茨木市、理事長:中村祐輔)は2015 年 4 月 1 日に医薬基盤研究所と国立健康・栄養研究所が統合し、設立されました。本研究所は、メディカルからヘルスサイエンスまでの幅広い研究を特⾧としており、我が国における科学技術の水準の向上を通じた国民経済の健全な発展その他の公益に資するため、研究開発の最大限の成果を確保することを目的とした国立研究開発法人として位置づけられています。
◆ VLPセラピューティクス・ジャパン(VLPTジャパン)について[https://vlptherapeutics.co.jp]
VLP Therapeutics Japan株式会社(本社:東京都港区、代表取締役:赤畑渉)は2020年、米国 VLP Therapeutics, Inc. の100%子会社として設立されました。2023年現在、国立研究開発法人日本医療研究開発機構(AMED)及び厚生労働省の支援により、新型コロナウイルス感染症(COVID-19)等に対するワクチンを国内数機関と共同研究開発中です。
◆ VLPセラピューティクス(VLPT)について[https://vlptherapeutics.com]
VLP Therapeutics, Inc.(本社:米国メリーランド州ゲイサーズバーグ、CEO:赤畑渉)は2013年、世界の「満たされていないメディカル・ニーズ」に応え、従来のワクチン療法を一変する革新的な治療法を開発するため、赤畑渉が上野隆司博士、久能祐子博士らと設立しました。2023年現在、がんに対する治療ワクチンと、マラリア、デング、新型コロナウイルス感染症に対する予防ワクチンの研究開発を進めています。