ファイザーワクチンに見られる副反応のロット差

先の論考で、コロナワクチン接種後死亡数の頻度を検討したところ、2022年は2021年に比較して著減したことが判明した。
ワクチンの総接種回数は2021年が1億7千万回、2022年が1億6千万回と変わらないことから、2021年に納入されたロットは2022年に納入されたロットと比較して死亡リスクが高い可能性がある。そこで、コロナワクチンの死亡報告数にロット間で差があるかを検討した。
コロナワクチンによる死亡リスクのロット間の差については、これまでもSNS上では話題となっている。すでに、2021年9月の鎌倉市議会において、ワクチン接種後の死亡数がロット間で大きな差があることが質問されている。
この質問に対して、ファイザー社は、全てのロットにおいて、事前に定められた品質を維持するための基準をクリアーした製剤のみを出荷しており、ロット間により死亡リスクが異なる可能性はないと回答している。
厚労省からも、副反応疑いとして報告された症例は、厚生科学審議会・副反応検討部会において検討され、特定のロットにおいて死亡リスクが高いことはないとの見解が示されていると回答されている。
厚生科学審議会予防接種・ワクチン分科会副反応検討部会に提出された資料には各製剤のロットについて納入数、重篤副反応報告数、死亡報告数、死亡報告頻度が公表されている。今回は、ファイザー社1価ワクチンの公表結果を示す。
図1には、各ロットの死亡報告の頻度を示す。最も高いロットの報告頻度は0.0024%で、0%のロットも9ロットみられた。中央値は0.0003%で、0.001%以上のロットが13ロットみられた。
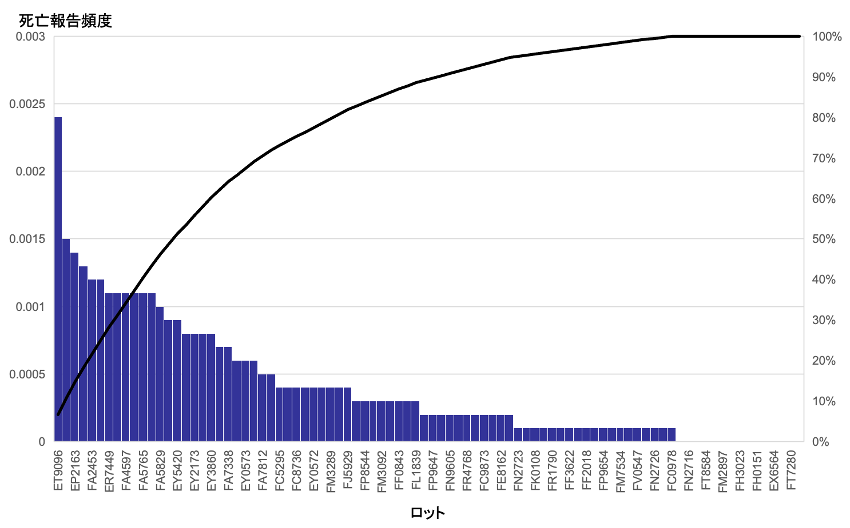
図1 ファイザーワクチンの各ロットにおける死亡報告頻度
出典:2023年7月28日開催厚生科学審議会資料
図2には重篤な副反応の報告頻度を示すが、同様にロット間で著しい差がみられた。
重篤の定義は、
- 死亡
- 障害
- それらに繋がるおそれのあるもの
- 入院
- 1〜4に準じて重いもの
- 後世代における先天性の疾病又は異常のもの
とされている。
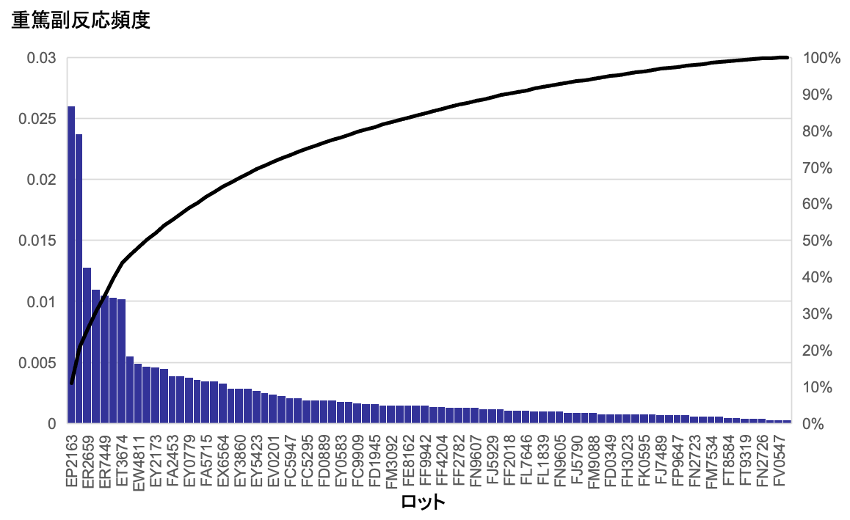
図2 ファイザーワクチンの各ロットにおける重篤副反応報告頻度
2023年7月28日開催厚生科学審議会資料
図3には各ロットの納入時期を示す。
死亡報告頻度が0.001%以上のロットは全て2021年5月末までに納入されていた。2021年7月以降に納入されたロットの報告頻度は全て0.0005%以下であった。2022年に納入された22ロットでは、報告頻度が0%のロットが8ロット、0,0001%のロットが8ロットと死亡リスクの低いロットが過半を占めた。
一方、2021年の4月、5月の2ヶ月間に納入された20ロットでは死亡報告頻度が0.001%以上のロットが12ロットみられ、納入時期によって死亡報告の頻度が大きく異なっていた。
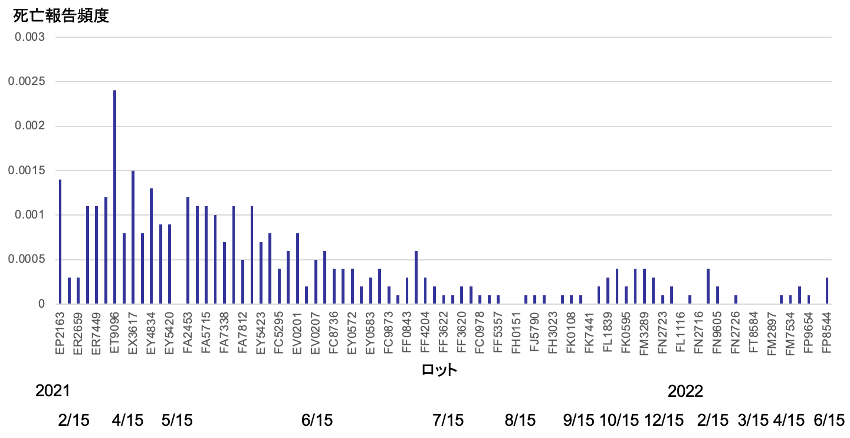
図3 ファイザーワクチンの納入時期による死亡報告頻度の違い
2023年7月28日開催厚生科学審議会資料
表1には、各ロットの出荷開始日、ロット別納入数と死亡報告頻度を示す。死亡報告頻度が0.0024%と最も高いET9096では納入数が462,150本と不自然に少なかった。このロットの納入数が不自然に少ないのは、このロットが危険であることを察知し出荷が止められたのかもしれない。

表1 ファイザーワクチン各ロットの出荷開始日、納入数と死亡報告頻度
2023年7月28日開催厚生科学審議会資料
ファイザー社や厚労省がワクチンの死亡リスクにロット差があることを否定しているが、厚労省の公表データを見る限り、死亡リスクにロット間で差があることは認めざるを得ない。
最近、デンマークからもファイザーワクチンに見られる副反応のロット差が報告された。
Batch-dependent safety of the BNT162b2 mRNA COVID-19 vaccine
デンマークでは、2020年12月から2022年1月までに、52ロットのファイザーワクチンが使用された。ちなみにデンマークの人口は4,026,575人でこの間の総接種回数は10,793,766回であるが、重篤な副反応が14,509件、死亡が579件報告された。
副反応の頻度はロット間で大きな差がみられ高リスク群、中間リスク群、低リスク群に分けられた。高リスク群には9ロット(17%)が属したが、1ロットあたりの接種回数は少なく、総接種回数に占める割合は4%に過ぎなかった。一方、死亡報告の47%、重篤副反応報告の28%は高リスク群に属するロットからの報告例であった。(図4)
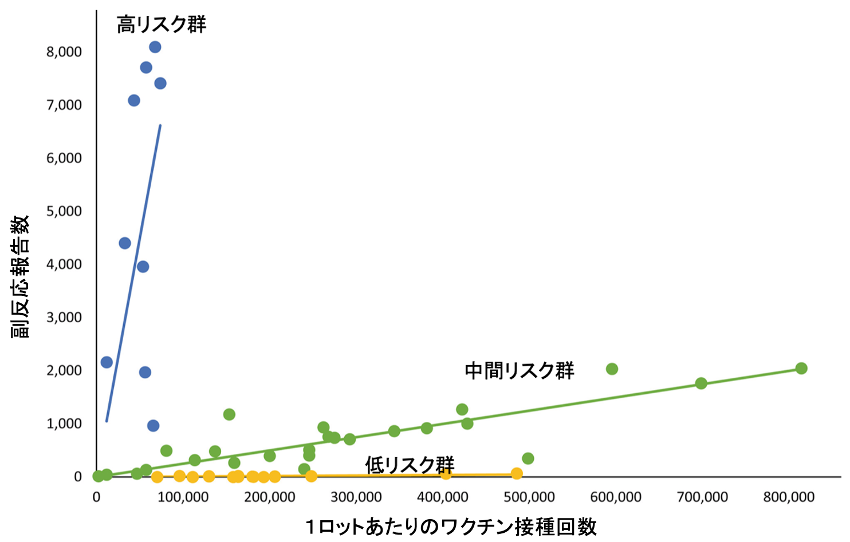
図4 デンマークにおけるファイザーワクチンの副反応報告数のロット差
出典:European J of Clinical Investigation 53, Issue8/e13998
コロナワクチンはスパイクタンパクの設計図であるmRNAを脂質の膜で包んだものであるが、脂質の膜に入っているmRNAの量にバラツキがあることが知られている。産生されるスパイクタンパクはmRNAの含有量に依存するので、体内で産生されるスパイクタンパクの量もロット間でバラツキがみられるのであろう。
心筋炎・心膜炎をはじめ、コロナワクチン接種後の副反応はスパイクタンパクの毒性によると考えられている。
‘Spikeopathy’: COVID-19 Spike Protein Is Pathogenic, from Both Virus and Vaccine mRNA
死亡報告頻度が2021年7月以降に減少したのは、7月以降に納入されたロットの含むmRNA含有量が減少したことが考えやすい。
医薬品にとって均一な品質保証が最重要課題である。ファイザーワクチンの薬事申請書類には、品質管理の方法が記載されており、製剤の安全性に影響する品質特性として封入RNA、RNA含量、脂質含量があげられていることから、ファイザー社には、各ロットのRNA含量が記録されていると思われる。7月以降に納入されたロットの死亡報告頻度が著減したのは、出荷するロットのRNA含量の基準が変えられたのかもしれない。
筆者の所属する名古屋大学では、大学病院内の施設で遺伝子治療製剤や細胞治療製剤の製造を以前から行ってきた。均一な製剤を保証するために、ISO9001のもとでGMP基準に準拠した施設を保有している。筆者も、ウイルス特異的T細胞製剤やキメラ抗原受容体療法製剤の開発に関与したので、製剤の品質管理については人一倍気になるところである。
このようにロット間で死亡報告の頻度に大きな差がみられたのはmRNA製剤が開発から市場に出回るまでの期間が、他の薬剤と比較してとりわけ短期間であったことと関係あるのかもしれない。日本国内であれば、製造物責任法(PL法)の対象になる事案かもしれない。